Kekuatan Asam Dan Basa Dalam Kimia Organik
Kekuatan
Asam Dan Basa Dalam Kimia Organik
Contoh Asam dan Basa Organik
1. Fenol
Fenol termasuk kedalam golongan asam karbolat yang memiliki kekuatan asam lebih tinggi dibandingkan alkohol. Yang mana fenol ini memiliki cincin aromatik yang dapat teresonansi sehingga memberikan tingkat keasaman yang lebih tinggi dibanding alkohol. pKa dari fenol ialah 11 lebih kecil disbanding pKa dari alcohol yaitu 18. fenol lebih asam dari alcohol alifatik lainnya dapat dilihat dengan mereaksikan fenol dengan basa Natrium Hidroksida , yang mana Fenol akan melepaskan H+ yang berpotensi sebagai antiseptic, pembuatan obat-obatan (bahan dasar obat), serta berfungsi dalam sintesis senyawa aromatis yang terdapat didalam batu bara.
2. Asam askorbat
Asam askorbat merupakan asam organic dengan tingkat keasamaan yang tinggi. asam askorbat biasanya dikenal dengan vitamin C yang berperan sebagai antioksidan dalam pengendalian bakteri sehingga berpotensi sebagai pengawet dalam makanan juga pemberi rasa asam pada makanan dan minuman. asam arkorbat mudah teroksidasi oleh panas, cahaya bahkan Udara dan oksidasi ini akan terhambat jika dibiarkan dalam kondisi asam ataupun pada suhu yang rendah. asam askorbat mengalami oksidasi dengan melepas 2 atom hydrogen menjadi asam dehidroaskorbat, selanjutnya terhidrolisis menjadi 2,3 asam diketogulonat yang sudah tidak memiliki aktivitas seperti vitamin C. asam askorbat ataupun Vitamin C dapat diperoleh dari buah-buahan seperti jeruk, tomat, buah mete dan belimbing.
3. Asam Glutamat
Asam Glutamat terdiri dari 5 atom karbon dengan 2 gugus karboksil yang mana pada salah satu karbonnya berkaitannya dengan gugus amina (-NH2) yang menjadi ciri asam amino. asam glutamate memiliki isomer optic L dan D. Gugus karboksil yang telah terionisasi dapat mengaktifkan stimulasi rasa pada alat pengecap. asam glutamate yang terikat maupun yang memiliki isomer D, tidak memiliki kemampuan dalam menguatkan rasa seperti asam glutamate bebas dengan isomer L.
Asam Glutamat merupakan asam yang terkandung dalam 20 asam amino yang menyusun protein. Asam glutamate yang terkandung dalam berbagai macam tanaman umunya terikat bebas dalam protein. fungsinya adalah sebagai molekul penting dalam metabolism seluler, bahan untuk biosintesa dengan asam amino yang lain serta meningkatkan neurotransmitter untuk fungsi normal otak. monosodium glutamay berbentuk tepung kristal berwarna putih yang mudah larut dalam air, tidak berbau, yang biasanya digunakan sebagai penyedap rasa juga dapat digunakan sebagai penyubur tanaman sehingga cepat berbuah.
4. Amina
amina adalah senyawa organic yang mengandung atom nitrogen yang berikatan satu, dua atau tiga atom karbon. bila ditinjau dari rumus strukturnya, amina merupakan turunan dari ammonia yang satu, dua atau 3 atom hidrogennya digantikan oleh gugus alkil atau aril. sama seperti ammonia, amina bersifat sebagai basa lemah. amina juga bersifat polar dan antar molekul amina primer atau amina sekunder terdapat ikatan hydrogen. namun ikatan hydrogen antar molekul amina tidak sekuat ikatan ikatan hydrogen antar molekul alcohol. karena perbedaan elektronegativitas antar hydrogen-hydrogen dan oksigen-hidrogen.
kegunaan amina dalam kehidupan sehari hari sangatlah luas yaitu sebagai pemurnian air, pembuatan obat obatan da penegmbangan insektisida dan pestisida. selain itu amina terlibat dalam produksi asam amino yang merupakan bahan penyusun protein untuk mahluk hidup. selain asam amino, vitamin juga dibuat oleh amina ini.
Sifat sifat yang mempengaruhi kekuatan Asam dan Basa yaitu :
Efek
Induksi
Efek induksi dapat diartikan sebagai
kemampuan suatu gugus/atom yang terikat dalam suatu molekul untuk menolak atau
menarik elektron yang berakibat pada kekuatan asam dan basa suatu senyawa
organik.
Keasaman senyawa karboksilat baik berupa
senyawa alifatik maupun senyawa aromatic didasarkan pada harga pKa kedua asam
tersebut.
Kekuatan asam metanoat berbeda dengan
kekuatan asam etanoat, asam metanoat lebih kuat. Jika dilihat dari struktur
kedua asam diatas, dapat diperkirakan perbedaan kekuatan asamnya yang
disebabkxan oleh pengaruh gugus CH3. Dibandingkan asam metanoat,
kekuatan asam etanoat lebih lemah. Gugus –CH3 pada asam etanoat
mempunyai kemampuan mendorong elektron ikatan melalui ikatan sigma ( C-C-O-H )
sehingga atom O menjadi relative negative, akibatnya atom H sukar lepas sebagai
H+, dan asamnya menjadi lebih lemah. Gugus –CH3 dikatakan
mempunyai efek induksi mendorong elektron dan diberi symbol +1.
Dilihat dari struktur ketiga asam
diatas, perbedaan kekuatan asam dikarenakan adanya substituen –H pada asam (1),
-Cl pada asam (2) dan –OH pada asam (3). Substituent –Cl dan –OH mempunyai
kemampuan menarik elektron ikatan melalui ikatan sigma ( C-C-O-H ) sehingga atom
O menjadi relative positive , akibatnya atom H mudah lepas sebagai H+,
dan asamnya menjadi lebih kuat. Gugus –Cl dan –OH dikatakan mempunyai efek
induksi menarik elektron dan diberi symbol -1.
Efek induksi tidak hanya berpengaruh
terhadap keasaman tetapi juga terhadap kebasaan dan kereakifan senyawa karbon. Kebasaan
ammonia dan metil ammonia dapat berbeda karena adanya induksi dari gugus –CH3.
Kekuatan basa dapat ditinjau dari
kekmampuan molekul/senyawa untuk mendonorkan pasangan elektron bebasnya. Dilihat
dari kekuatan basanya, metil amina lebih kuat tetapi pKb nya lebih kecil. Hal ini
dikarenakan metil amina memiliki gugus –CH3. Gugus –CH3
ini mempunyai efek induksi mendorong elektron sehingga pasangan elektron bebas
pada atom N lebih mudah didonorkan. Akibatnya kebasaan metil amina lebih kuat
daripada ammonia.
Efek
Resonansi
Bila pada pergeseran elektron pada
ikatan sigma menyebabkan efek induksi, maka pergeseran elektron pada pada
ikatan pi atau ikatan rangkapnya akan menyebabkan terjadinya efek resonansi.
Gambar resonansi pada benzene
Resonansi pada 1,3 butadiena
Bentuk paling stabil diatas dibentuk
oleh ikatan kovalen lebih banyak dan semua atomnya memenuhi aturan octet (setiap
atom mempunyai/dikelilingi delapan elektron).
Efek resonansi (R) disebut juga efek
mesomeri (M). seperti halnya efek induksi, efek resonansi juga terdiri dari
efek resonansi positif dan efek resonansi negative.
Efek
Sterik
Efek sterik juga dapat mempengaruhi
kebasaan suatu senyawa ammonia.
Gambar dimetil amina dan trimetl amina.
Dari harga pKb dapat diketahui baha
trimetil amina merupakan basa yang lebih lemah daripada dimetil amina. Bila dilihat
dari jumlah gugus metil (–CH3) yang mendorong elektron +1,
seharusnya trimetil amina merupakan basa yang lebih kuat dibandingkan dimetil
amina. Tetapi keaadan ruang dimetil amina yang lebih ruah menyulitkan trimetil
amina untuk berinteraksi dengan spesi yang dapat menerima pasangan elektron
bebasnya. Dengan adanya efek ruang/sterik ini menyebabkan kebasaan trimetil
amina tidak lebih kuat dari dimetil amina.
Permasalahan :
1. Asam etanoat merupakan asam karboksilat
yang termasuk dalam golongan asam kuat. Ketika terjadi reaksi substitusi dengan
atom Cl akan menghasilkan Asam 2 kloro etanoat seperti pada gambar berikut.
Apakah perubahan atom H menjadi Cl akan
berpengaruh terhadap tingkat keasamannya?
Fenol dan Siklo heksanol adalah
asam-asam organik yang memiliki struktur yang sama. Tetapi mengapa dengan
adanya cincin aromatic tersebut keasaman Fenol jauh lebih tinggi dibandingkan
dengan siklo heksanol?
3. Jika dilihat dari jumlah gugus metil (-CH3)
Trimetil amina merupakan basa yang lebih lemah dibandingkan Dimetil amina dan
Metil amina. Coba anda jelaskan Mengapa jumlah gugus metil (-CH3)
berpengaruh terhadap tingkat kebasaan tiga senyawa berikut?

















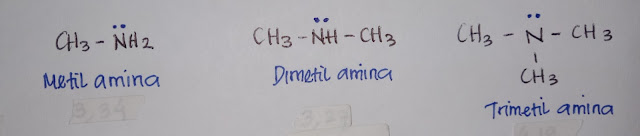

Halo neng! Saya akan membantu menjawab permasalahan no.1 menurut saya iya, akan berpengaruh pada tingkat keasaman senyawa tersebut. Karena atom klor bersifat elektronegatif, klor menarik kerapatn elektron dari elektron gugus karboksil ke dirinya. Penarikan elektron ini mengakibatkan delokalisasi lebih jauh dari muatan negatif. Jadi menstabilkan anion dan menambahkan kekuatan asam dari asamanya.
BalasHapusTerimakasih, semoga membantu
2. Hal ini dikarenakan pada struktur fenol lebih banyak terjadi delokalisasi dibandingkan dengan struktur dari sikloheksanol
BalasHapusTerimakasih
Komentar ini telah dihapus oleh pengarang.
BalasHapusNo. 3
BalasHapusPada tritimetil amina mengapa sanga t lemah dikarenakan pada atom pusatnya susah untuk mendonorkan elektron. Dimana pada teori asam basa bronsted lowri basa itu mudah untu mendonorkan elektron.